Химические реакции сопровождаются поглощением или выделением энергии, в частности тепла. реакции, сопровождающиеся поглощением тепла, а также образующиеся при этом соединения называются эндотермическими. При эндотермических реакциях нагрев реагирующих веществ необходим не только для возникновения реакции, но и в течение всего времени их протекания. Без нагревания извне эндотермическая реакция прекращается.
реакции, сопровождающиеся выделением тепла, а также образующиеся при этом соединения называются экзотермическими. Все реакции горения относятся к экзотермическим. Вследствие выделения тепла они, возникнув в одной точке, способны распространяться на всю массу реагирующих веществ.
Количество тепла, выделяемое при полном сгорании вещества и отнесенное к одному молю, единице массы (кг, г) или объема (м 3 ) горючего вещества называется теплотой сгорания. Теплоту сгорания можно вычислить по табличным данным, пользуясь законом Гесса. Русский химик Г.Г. Гесс в 1840 г. открыл закон, который является частным случаем закона сохранения энергии. Закон Гесса состоит в следующем: тепловой эффект химического превращения не зависит от пути, по которому реакция протекает, а зависит лишь от начального и конечного состояний системы при условии, что температура и давление (или объем) в начале и в конце реакции одинаковы.
Рассмотрим это на примере вычисления теплоты сгорания метана. Метан можно получить из 1 моля углерода и 2 молей водорода. При сжигании метана получаются 2 моля воды и 1 моля диоксида углерода.
Те же продукты образуются при сгорании водорода и углерода. При этих реакциях общее количество выделяющегося тепла равно 963,5 кДж.
 |
Поскольку начальные и конечные продукты в обоих случаях одинаковы, их общие тепловые эффекты должны быть равны согласно закону Гесса, т.е.
Следовательно, теплота сгорания метана будет равна
Qгор = 963,5 — 74,8 = 888,7 кДж/моль.
Таким образом, теплота сгорания химического соединения (или их смеси) равна разности между суммой теплот образования продуктов сгорания и теплотой образования сгоревшего химического соединения (или веществ, составляющих горючую смесь). Следовательно, для определения теплоты сгорания химических соединений необходимо знать теплоту их образования и теплоту образования продуктов, получающихся после сгорания.
Ниже приведены значения теплот образования некоторых химических соединений:
Оксид углерода CO ………….
Диоксид углерода CO2 ………
Пример 1.5.Определить температуру сгорания этана, если теплота его образования Q1 = 88,4 кДж. Напишем уравнение горения этана.
Для определения Qгор необходимо знать теплоты образования продуктов сгорания. теплота образования диоксида углерода 396,9 кДж, а воды 286,6 кДж. Следовательно, Q будет равно
а теплота сгорания этана
Теплоту сгорания экспериментально определяют в калориметрической бомбе и газовом калориметре. Различают высшую и низшую теплоты сгорания. Высшей теплотой сгорания Qв называют количество тепла, выделяемое при полном сгорании 1 кг или 1 м 3 горючего вещества при условии, что содержащийся в нем водород сгорает с образованием жидкой воды. Низшей теплотой сгорания Qн называют количество тепла, выделяемое при полном сгорании 1 кг или 1 м 3 горючего вещества при условии сгорания водорода до образования водяного пара и испарении влаги горючего вещества.
Высшую и низшую теплоты сгорания твердых и жидких горючих веществ можно определить по формулам Д.И. Менделеева:
где Qв, Qн — высшая и низшая теплоты сгорания, кДж/кг; W – содержание в горючем веществе углерода, водорода, кислорода, горючей серы и влаги, %.
Пример 1.6. Определить низшую температуру сгорания сернистого мазута, состоящего из 82,5 % С, 10,65 % Н, 3,1 % S и 0,5 % О; А (зола) = 0,25 %, W = 3 %. Используя уравнение Д.И. Менделеева (1.13), получаем
Низшую теплоту сгорания 1 м 3 сухих газов можно определить по уравнению
Низшая теплота сгорания некоторых горючих газов и жидкостей, полученная экспериментально, приведена ниже:
Низшая теплота сгорания некоторых горючих материалов, рассчитанная по их элементному составу, имеет следующие значения:
в конструкциях зданий…
Существует нижний предел теплоты сгорания, ниже которого вещества становятся не способными к горению в атмосфере воздуха.
Практически в процессе горения, особенно на пожарах, указанная в таблицах теплота сгорания полностью не выделяется, так как горение сопровождается недожогом. Известно, что нефтепродукты, а также бензол, толуол, ацетилен, т.е. вещества, богатые
углеродом, горят на пожарах с образованием значительного количества сажи. Сажа (углерод) способна гореть и выделять тепло. Если при горении она образуется, то, следовательно, горючее вещество выделяет тепла меньше того количества, которое указано в таблицах. Для веществ, богатых углеродом, коэффициент недожога h составляет 0,8 — 0,9. Следовательно, на пожарах при горении 1 кг резины может выделиться не 33520 кДж, а только 33520´0,8 = 26816 кДж.
Размер пожара обычно характеризуется площадью пожара. Количество тепла, выделяющееся с единицы площади пожара в единицу времени, называют теплотой пожара Qп
где υм – массовая скорость выгорания, кг/(м 2 ×с).
Удельная теплота пожара при внутренних пожарах характеризует тепловую нагрузку на конструкции зданий и сооружений и используется для расчета температуры пожара.
1.6. Температура горения
Выделяющееся в зоне горения тепло воспринимается продуктами сгорания, поэтому они нагреваются до высокой температуры. Та температура, до которой в процессе горения нагреваются продукты сгорания, называется температурой горения. Различают калориметрическую, теоретическую и действительную температуры горения. Действительная температура горения для условий пожара называется температурой пожара.
Под калориметрической температурой горения понимают ту температуру, до которой нагреваются продукты полного сгорания при следующих условиях:
1) всё выделяющееся при горении тепло расходуется на нагревание продуктов сгорания (потери тепла равны нулю);
2) начальные температуры воздуха и горючего вещества равны 0 0 С;
3) количество воздуха равно теоретически необходимому (a = 1);
4) происходит полное сгорание.
Калориметрическая температура горения зависит только от состава горючего вещества и не зависит от его количества.
Теоретическая температура, в отличие от калориметрической, характеризует горение с учетом эндотермического процесса диссоциации продуктов сгорания при высокой температуре
2СО2 
2Н 2 О
Практически диссоциацию продуктов сгорания необходимо учитывать только при температуре выше 1700 0 С. При диффузионном горении веществ в условиях пожара действительные температуры горения не достигают таких значений, поэтому для оценки условий пожара используют только калориметрическую температуру горения и температуру пожара. Различают температуру внутреннего и наружного пожара. Температура внутреннего пожара – это средняя температура дыма в помещении, где происходит пожар. Температура наружного пожара – температура пламени.
При расчете калориметрической температуры горения и температуры внутреннего пожара исходят из того, что низшая теплота сгорания Qн горючего вещества равна энергии qг, необходимой для нагревания продуктов сгорания от 0 0 С до калориметрической температуры горения
Величину qг назовем условно теплосодержанием продуктов сгорания
qг = 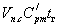
где 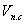
Поскольку продукты сгорания состоят из нескольких газообразных веществ, теплоемкость которых различна, суммарное теплосодержание их может быть выражено следующим образом:
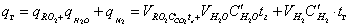
где 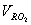
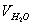
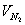
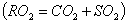
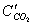
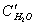
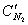
В действительности не вся теплота, выделяющаяся при горении в условиях пожара, расходуется на нагревание продуктов сгорания. Большая часть её расходуется на нагревание конструкций, подготовку горючих веществ к горению, нагревание избыточного воздуха и др. Поэтому температура внутреннего пожара значительно ниже калориметрической. Методика расчета температуры горения предполагает, что весь объем продуктов сгорания нагрет до одной и той же температуры. В действительности температура в различных точках очага горения неодинакова. Наиболее высокой является температура в области пространства, где протекает реакция горения, т.е. в зоне горения (пламени). Значительно ниже температура в местах, где находятся горючие пары и газы, выделившиеся из горящего вещества и продуктов сгорания, смешавшихся с избытком воздуха.
Чтобы судить о характере изменения температуры при пожаре в зависимости от различных условий горения, введено понятие среднеобъемной температуры пожара, под которой понимают среднее значение из величины температур, измеренных термометрами в различных точках внутреннего пожара. Эта температура определяется из опыта.
Срочно?
Закажи у профессионала, через форму заявки
8 (800) 100-77-13 с 7.00 до 22.00
| Показатель | Этан | Этилен | Пропан | Пропилен | н-Бутан | Изобутан | н-Бутилен | Изобутилен | н-Пентан |
|---|---|---|---|---|---|---|---|---|---|
| Химическая формула | С2Н6 | С2Н4 | С3Н8 | С3Н6 | С4Н10 | С4Н10 | С4Н8 | С4Н8 | С5Н12 |
| Молекулярная масса M | 30,068 | 28,054 | 44,097 | 42,081 | 58,124 | 58,124 | 56,108 | 56,104 | 72,146 |
| Молярный объем VМ, м³/кмоль | 22,174 | 22,263 | 21,997 | 21,974 | 21,50 | 21,743 | 22,442 | 22,442 | 20,87 |
| Плотность газовой фазы, кг/м³: | |||||||||
| при 0 °С и 101,3 кПа рu0 | 1,356 | 1,260 | 2,0037 | 1,9149 | 2,7023 | 2,685 | 2,55 | 2,5022 | 3,457 |
| при 20 °С и 101,3 кПа pu20 | 1,263 | 1,174 | 1,872 | 1,784 | 2,519 | 2,486 | 2,329 | 2,329 | 3,221 |
| Плотность жидкой фазы, кг/м³, при 0 °С и 101,3 кПа, рж | 0,546 | 0,566 | 0,528 | 0,609 | 0,601 | 0,582 | 0,646 | 0,646 | 0,6455 |
| Относительная плотность dn | 1,0487 | 0,9753 | 1,5545 | 1,4811 | 2,0995 | 2,0634 | 1,9336 | 1,9336 | 2,6736 |
| Удельная газовая постоянная R, Дж/(кг×К) | 271,18 | 261,26 | 184,92 | 193,77 | 140,3 | 140,3 | 145,33 | 145,33 | 113,014 |
| Температура, °С, при 101,3 кПа: | |||||||||
| кипения tкип | –88,6 | –104 | –42,1 | –47,7 | –0,5 | –11,73 | –6,9 | –3,72 | –36,07 |
| плавления tпл | –183,3 | –169 | –187,7 | –185,3 | –138,3 | –193,6 | –140,4 | –138,9 | –129,7 |
| Температура критическая tкр, °С | +32,3 | +9,9 | +96,84 | +91,94 | +152,01 | +134,98 | +144,4 | +155,0 | +196,6 |
| Давление критическое ркр, МПа | 4,82 | 5,033 | 4,21 | 4,54 | 3,747 | 3,60 | 3,945 | 4,10 | 3,331 |
| Теплота плавления Qпл, кДж/кг | 122,6 | 119,7 | 10,64 | — | — | — | — | — | — |
| Теплота сгорания, МДж/м³: | |||||||||
| высшая Qв р | 69,69 | 63,04 | 99,17 | 91,95 | 128,5 | 128,28 | 121,4 | 121,4 | 130,0 |
| низшая Qн р | 63,65 | 59,53 | 91,14 | 86,49 | 118,53 | 118,23 | 113,83 | 113,83 | 146,18 |
| Теплота сгорания, МДж/кг: | |||||||||
| высшая Qв р | 51,92 | 51,24 | 50,37 | 49,95 | 49,57 | 49,45 | 49,31 | 49,31 | 49,20 |
| низшая Qн р | 47,42 | 47,23 | 46,3 | 46,04 | 45,76 | 45,68 | 45,45 | 45,45 | 45,38 |
| Число Воббе, МДж/м³: | |||||||||
| высшее W0в | 68,12 | 64,03 | 79,8 | 75,72 | 89,18 | 93,53 | 87,64 | 87,64 | 93,73 |
| низшее W0н | 62,45 | 60,03 | 73,41 | 70,92 | 82,41 | 86,43 | 81,94 | 81,94 | 86,56 |
| Удельная теплоемкость газа cГ, кДж/(кг°С), при 0 °С и: | |||||||||
| постоянном давлении ср | 1,6506 | 1,4658 | 1,554 | 1,4322 | 1,596 | 1,5690 | 1,4868 | 1,6044 | 1,6002 |
| постоянном объеме сv | 1,3734 | 1,1634 | 1,365 | 1,222 | 1,4574 | 1,4574 | 1,3398 | 1,445 | 1,424 |
| То же, жидкой фазы сж, кДж/(кг °С), при 0 °С и 101,3 кПа | 3,01 | 2,415 | 2,23 | — | 2,239 | 2,239 | — | — | 2,668 |
| Показатель адиабаты, К, при 0 °С и 101,3 кПа | 1,202 | 1,26 | 1,138 | 1,172 | 1,095 | 1,095 | 1,11 | 1,11 | 1,124 |
| Теоретически необходимое количество воздуха для горения Lт.в., м³/м³ | 16,66 | 14,28 | 23,8 | 22,42 | 30,94 | 30,94 | 28,46 | 28,56 | 38,08 |
| То же, кислорода Lт.к., м³/м³ | 3,5 | 3,0 | 5,0 | 4,5 | 6,5 | 6,5 | 6,0 | 6,0 | 8,0 |
| Объем влажных продуктов сгорания, м³/м³, при а = 1: | |||||||||
| CO2 | 2,0 | 2,0 | 3,0 | 3,0 | 4,0 | 4,0 | 4,0 | 4,0 | 5,0 |
| H2O | 3,0 | 2,0 | 4,0 | 3,0 | 5,0 | 5,0 | 4,0 | 4,0 | 6,0 |
| N2 | 13,16 | 11,28 | 18,8 | 16,92 | 24,44 | 24,44 | 20,68 | 20,68 | 30,08 |
| Всего | 18,16 | 15,28 | 25,80 | 22,92 | 33,44 | 33,44 | 28,68 | 28,68 | 41,08 |
| Скрытая теплота испарения при 101,3 кПа: | |||||||||
| кДж/кг | 487,2 | 483,0 | 428,4 | 441,0 | 390,6 | 383,2 | 411,6 | 299,0 | 361,2 |
| кДж/л | 230,2 | 221,8 | 220,1 | 241,1 | 229,7 | 215,0 | 255,4 | 239,4 | — |
| Объем паров с 1 кг сжиженных газов при нормальных условиях Vп, м³ | 0,745 | 0,8 | 0,51 | 0,52 | 0,386 | 0,386 | 0,4 | 0,4 | 0,312 |
| То же, с 1 л | 0,31 | 0,34 | 0,269 | 0,287 | 0,235 | 0,229 | 0,254 | 0,254 | 0,198 |
Данный интернет-сайт носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями статьи 437 Гражданского кодекса РФ. Для получения информации об условиях сотрудничества, пожалуйста, обращайтесь к сотрудникам ГК «Газовик».
Бесплатная телефонная линия: 8-200-2000-230
© 2007–2019 ООО «Газ-Сервис». Все права защищены.
Использование материалов сайта без разрешения владельца запрещено и будет преследоваться по закону.
Теплотехнические характеристики горючих газов. Низшая теплота сгорания (теплотворная споcобность). Потребность в воздухе для сгорания. Объем продуктов горения. Плотность. Метан, Этан, Пропан, Бутан, Пентан, Этилен, Ацетилен, Окись углерода (угарный газ), Сероводород, Пропилен, Бутилен.
