Виды коррозии по механизму протекания процесса:
— химическая — это вид коррозионного разрушения, связанный с взаимодействием металла и коррозионной среды, при котором одновременно окисляется металл и происходит восстановление коррозионной среды;
— электрохимическая — процесс взаимодействия металла с коррозионной средой, при котором восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости.
Виды коррозии по условиям протекания:
— атмосферная коррозия — наиболее распространенный вид коррозии, связанный с разрушением металлов в атмосфере воздуха;
— газовая — коррозионное разрушение металла под воздействием газов при высоких температурах;
— жидкостная — вид коррозии металла в жидкой среде, который подразделяется на коррозию в электролитах и неэлектролитах;
— биокоррозия — вид коррозии, связанный с разрушением под влиянием живых микроорганизмов;
— структурная — связанная с неоднородностью структуры металлов;
— коррозия блуждающими токами — вид электрохимического разрушения под воздействием блуждающих токов;
— внешним током — электрохимическое разрушение металла под влиянием тока от внешнего источника;
— контактная коррозия — возникает при контакте разнородных металлов (имеющих разные стационарные потенциалы в данном электролите);
— щелевая коррозия — явление повышения скорости коррозионного разрушения в зазорах и щелях в металле;
— коррозия под напряжением — разрушение металла при одновременном воздействии агрессивной среды и механических напряжений;
— кавитация — разрушение металла при одновременном воздействии ударного воздействия внешней среды и коррозионного процесса;
— фреттинг-коррозия — вид коррозии, возникающий при колебательных перемещениях двух поверхностей относительно друг друга в условиях коррозионной среды;
— коррозия при трении (коррозионная эрозия) — происходит при одновременном воздействии на металл трения и коррозионной среды;
Виды коррозии по характеру разрушения:
— сплошная (общая коррозия) — охватывающая всю поверхность металла, которая находится под воздействием коррозионной среды;
— местная — распространяется лишь на некоторых участках поверхности металла.
Сплошная коррозия подразделяется на: равномерную, неравномерную и избирательную.
Местный вид коррозии бывает: пятнами, питтинговой, язвенной, сквозной, нитевидной, межкристаллитной, подповерхностной, ножевой, коррозионным растрескиванием и коррозионной хрупкостью.
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Различают два вида коррозии – химическую и электрохимическую. Х
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой. Основной вклад в газовую коррозию металла вносит кислород воздуха. Различные металлы обладают различной устойчивостью по отношению к О2. Некоторые металлы (Al, Cr, Zn, Pb, Sn) образуют на воздухе плотные пленки оксидов, не разрушающиеся при изгибе или нагревании. Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
2Fe + O2=2FeO
Fe(OH)3= t H2O+FeOOH (ржавчина)
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
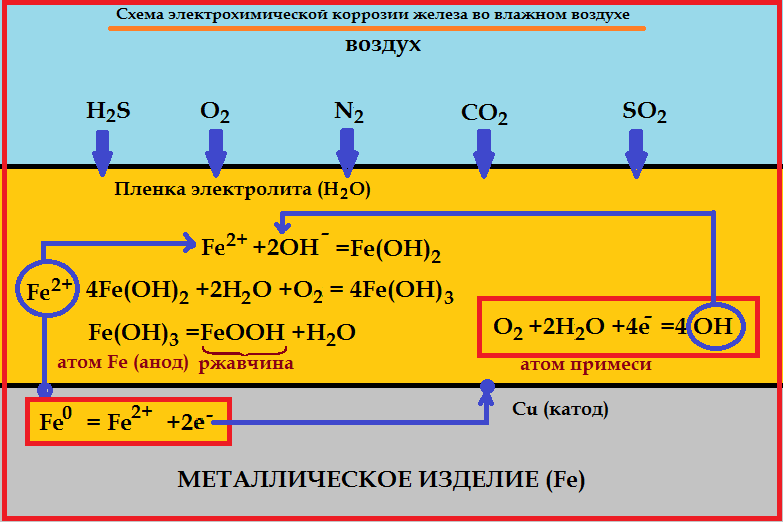
Сущность электрохимической коррозии
Металлы обычно содержат примеси других металлов и неметаллов. При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н + – в кислой среде.
На аноде происходит окисление атомов металла, из которых состоит анод, с образованием катионов Me n+ .
Последние переходят в электролит (растворение анода) и соединяются с ионами ОН – , с образованием гидроксида Me (OH) n и других продуктов. Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии. Однако, так ка абсолютно чистым металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
Коррозия – процесс поверхностный и при отсутствии трещин внутри металла развиваться не может. Поэтому одним из способов защиты от коррозии является нанесение на поверхность металла металлических и неметаллических покрытий.
В качестве металлических покрытий используются пленки Au, Ag, Ni, Cr, Zn и других металлов, которые мало подвергаются коррозии из-за своей индифферентности или по причине образования прочных оксидных пленок. Некоторые из этих металлов (Au, Ag, Ni, Cr), помимо защитной, выполняют и эстетическую – придают изделиям приятный внешний вид.
Различают два вида металлических покрытий – анодное и катодное. Покрытие называется
- анодным, если оно изготовлено из металла более активного, чем защищаемый;
- катодным, если изготовлено из менее активного металла.
Примером анодных покрытий для изделий из железа являются пленки из Cr, Zn, примером катодных – пленки из Ni, Sn, Ag, Au. Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Неметаллические покрытия также делятся на два вида: неорганические и органические. В качестве органических покрытий используются пленки лаков, красок, пластмасс, резины, битума, в качестве неорганических – эмали.
Протекторная защита заключается в соединении защищаемого изделия проводником с протектором – пластиной из более активного металла (Al, Mg, Zn). В процессе коррозии протектор служит анодом и разрушается, предохраняя от коррозии металлическое изделие или конструкцию.
Электрохимическая (катодная) защита заключается в соединении защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Анодом служит вспомогательный, обычно стальной, электрод (кусок металла), который и разрушается в процессе коррозии.
Коррозия – это процесс разрушения металлов под воздействием электрохимических или химических факторов окружающей среды. Отсюда, различают два типа коррозии, в зависимости от способа взаимодействия с окружающей средой и механизму протекания процесса окисления: химическая коррозия и электрохимическая коррозия.
Химическая коррозия – предполагается, что процессы, протекают без участия электрического тока. В результате: на поверхности металла образуются различные химические соединения: оксиды, сульфиды и др. (например, при нагреве стали для термической обработки или обработки давлением).
Но есть и плюсы такой коррозии: пленка, образовавшаяся на металле в результате процесса химической коррозии, служит препятствием для дальнейшего разрушения металла. Это происходит, например, у таких металлов, как свинец, олово, алюминий, никель и хром. На их поверхности образуется плотная пленка оксида. А вот на поверхности стали и чугуна пленка образуется непрочная, тонкая, она растрескивается и ведет к дальнейшей коррозии.
 |
 |
Электрохимическая коррозия протекает в присутствии электрического тока. Такая коррозия возникает в результате работы множества макро- или микрогальванопар в металле, соприкасающемся с электролитом.
Причины возникновения гальванических пар в металлах:
— соприкосновение двух разнородных металлов;
— наличие в металле примесей;
— наличие участков с различным кристаллическим строением;
— образование пор в окисной пленке;
— наличие участков с различной механической нагрузкой;
— наличие участков с неравномерным доступом активных компонентов внешней среды, например, воздуха.

Резкого отличия между механизмами протекания химической и электрохимической коррозии нет. Процесс химической коррозии может плавно перейти к электрохимической, и наоборот, а также носить двоякий характер, как это бывает при электролизе.
В зависимости от условий протекания, коррозия металлопроката — труб бесшовных бывает:










щелевая коррозия (протекает в зазорах между деталями механизмов) 
В зависимости от характера и места распространения, различают следующие подвиды коррозии:
 |
 |
 |



О большей степени устойчивости стали к коррозии можно определить по процентному содержанию в ее составе углерода. Например, уменьшив до 0.015% содержание углерода в составе легированной хромоникелевой стали Х18Н9, возможно максимально повысить ее сопротивление к межкристаллитной коррозии.