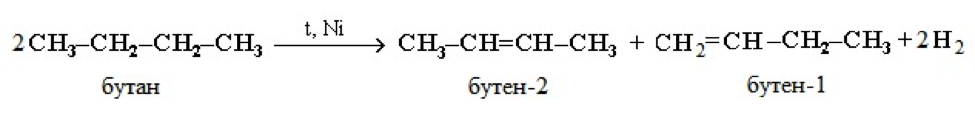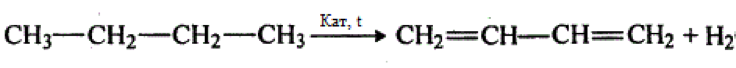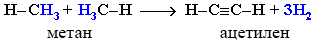Установите соответствие между веществом и продуктом его дегидрирования при нагревании с катализатором: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТ ДЕГИДРИРОВАНИЯ |
Г) гексан
6) толуол
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
| A | Б | В | Г |
При нагревании с катализатором дегидрирования:
А) циклогексан превращается в бензол (1)
;
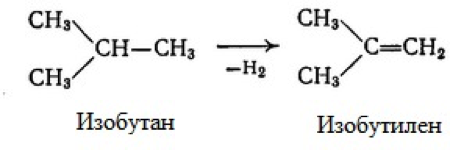
Б) изобутан превращается в 2-метилпропен (2)
;
В) гептан превращается в метилбензол (толуол) (6)
;
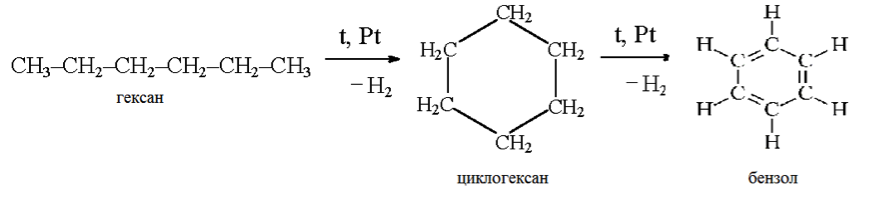
Г) гексан превращается в бензол (1)
.
Дегидрирование предельных углеводородов, принадлежащих к классу алканов, протекает при высоких температурах (до 650 °С) и в присутствии таких катализаторов, как платина, палладий, никель, железо, оксиды хрома, железа и цинка). Основными факторами, влияющими на дегидрирование алканов, являются длина цепи и температура процесса.
Дегидрирование этана, пропана и бутана протекает при температуре 500 °С в присутствии никелевого катализатора с образованием соответствующих алкенов – этена, пропена и бутена. Причем в случае дегидрирования бутана образуется смесь алкенов, состоящая из бутена-1 и бутена-2.
Если проводить дегидрирование бутана при температуре 500 — 650 °С на оксиде хрома, то можно получить бутадиен-1,3.
Одним из методов промышленного получения изобутилена – ценного сырья для нефтехимии, является дегидрирование изобутана. Процесс протекает на алюмохромовом катализаторе при температуре 550 — 600 °С.
Алканы, имеющие в своей цепи более 4-х атомов углерода, в процессе дегидрирования образуют устойчивые циклоалканы. Если в основной цепочке алкана имеется 6 и более атомов углерода (гексан, гептан, октан и т.д.), то при температуре 300 — 400 °С, платиновом катализаторе и, например, при наличии алкильных радикалов получаются только 6-членные циклы. Далее эти циклоалканы дегидрируются до более устойчивых соединений – аренов. Примером такой реакции является получение бензола из гексана.
В случае дегидрирования пентана и других алканов с пятью атомами углерода в основной цепочке образуются пятичленные циклы.
Помимо этого существует процесс дегидрирования метана по межмолекулярному механизму, который протекает при температуре 1500 °С и в качестве конечно продукта получается ацетилен.
Очень важным промышленным процессом дегидрирования является синтез мономера изопрена, из которого получают ценный изопреновый каучук. На первой стадии данного процесса происходит дегидрирование изопентана до изоамиленов при температуре 530 — 610 ºС в присутствии алюмохромового катализатора. Особенность первой стадии заключается в том, что дегидрирование осуществляется в кипящем слое катализатора, то есть когда частицы катализатора поддерживаются в парящем состоянии за счет восходящего потока воздуха. На второй стадии изоамилены дегидрируются на железокалиевом катализаторе при температуре 550 — 650 ºС в присутствии водяного пара.
Подготовка к ЕГЭ по химии и олимпиадам
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:


| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
| Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом. |
С третичный–Н > С вторичный–Н > С первичный–Н
| Например, при бромировании 2-метилпропана преимущественно образуется 2-бром-2-метилпропан: |
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:

Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
| Например. При нитровании пропана образуется преимущественно 2-нитропропан: |
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, п ри дегидрировании этана образуются этилен или ацетилен:  |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:

Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана .
При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ:

Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
| Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды. |
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:

- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.

Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.