Что ты хочешь узнать?
Ответ
Проверено экспертом
ацетилен (этин) — алкин
- Комментарии
- Отметить нарушение
Ответ
Являются простейшими углеводородами.
Ацетиле́н — C 2 H 2 . Имеет тройную связь между атомами углерода , принадлежит к классу алкинов .
Мета́н — бесцветный газ (в нормальных условиях) без запаха , химическая формула — CH 4 .
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства
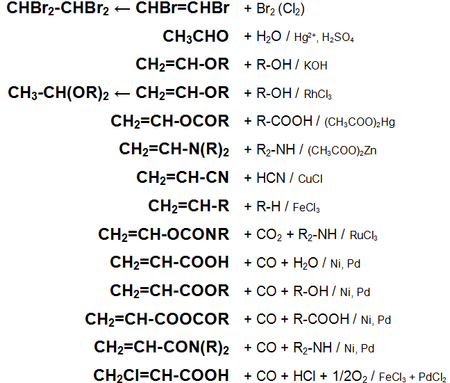
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
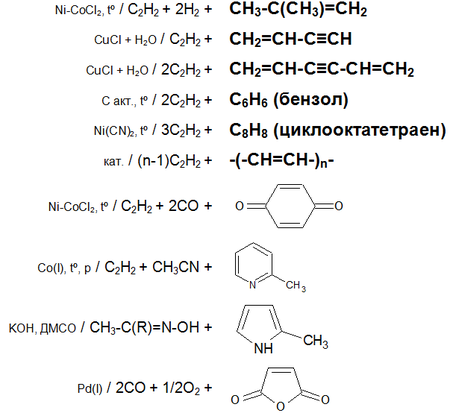
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Применение
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком) [2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м 3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Согласно одному из определений, органическая химия — это химия соединений углерода. Действительно, в настоящее время известно более 15 миллионов органических веществ и все они содержат атомы углерода. Лишь такие простейшие соединения углерода, как его оксиды, угольная кислота, карбонаты, галогениды, а также карбиды металлов изучает неорганическая химия.
Простейшие органические соединения — углеводороды. Все остальные органические вещества можно рассматривать как производные углеводородов. Так, есть углеводород метан СН4 — горючее вещество, основа природного газа. Метан можно считать родоначальником целого ряда производных. Заменим один атом водорода на карбоксильную группу —СООН и получим формулу известной вам уксусной кислоты СН3—СООН. Если атом водорода заменить на аминогруппу —NH2, получится метиламин СН3—NH2. Метиловый спирт получается при замене атома водорода в молекуле метана на гидроксогруппу: СН3—ОН. Наконец, можно заместить атом водорода на метильную группу —СН3, при этом образуется новый углеводород — этан СН3—СН3. Поэтому органическую химию можно определить как науку, изучающую углеводороды и их производные.
Причина многообразия органических соединений состоит в удивительной способности атомов углерода соединяться друг с другом с образованием длинных цепей (разветвлённых и нет):

а также замкнутых циклов:
Принципиальных отличий между веществами органическими и неорганическими не существует. Тем не менее можно выделить некоторые основные особенности органических веществ. Так, подавляющее большинство из них имеют молекулярное строение, т.е. состоят из отдельных молекул. Следствием этого являются довольно низкие температуры плавления и кипения органических соединений. Химические связи в молекулах органических соединений — ковалентные, в большинстве своём малополярные. Результатом этого является то, что органические вещества, за редким исключением, не являются электролитами.
Все органические вещества горючи, а при нагревании без доступа воздуха разлагаются. Химические реакции с участием органических веществ протекают медленнее, чем с участием веществ неорганических, зачастую требуют нагревания и использования катализаторов. Характерной особенностью реакций с участием органических веществ является одновременное параллельное протекание нескольких возможных процессов. Именно поэтому выход целевого конечного продукта бывает иногда весьма мал. Так, при нагревании оксида углерода(II) и водорода в зависимости от условий можно получить разные продукты:
Возможно образование метилового спирта, формальдегида, а также смеси углеводородов, используемой в качестве искусственного бензина. Применение подходящих катализаторов позволяет направить реакцию по нужному пути.
Основные классы органических соединений
Для классификации органических соединений рассматривают как углеродный скелет молекулы, так и находящиеся в молекуле функциональные группы (заместители). Углеродным скелетомназывают последовательность связанных между собой атомов углерода (в некоторых случаях и других атомов) в молекуле. Функциональные группы — это атомы или группы атомов, связанные с углеродным скелетом, определяющие наиболее характерные химические свойства органических веществ.
1. С точки зрения углеродного скелета все органические вещества можно разделить на ациклические (нециклические, алифатические) и циклические.
Ациклические соединения обычно подразделяют на предельные (насыщенные) и непредельные (ненасыщенные) в зависимости от того, отсутствуют или присутствуют в их молекулах кратные углерод-углеродные связи:
Циклические соединения делят на карбоциклические и гетероциклические. В молекулах карбоциклических соединений цикл образован только атомами углерода. В гетероциклах наряду с атомами углерода присутствуют и другие элементы, например кислород, азот, сера.
Карбоциклические соединения подразделяют на алициклические и ароматические. Ароматические соединения содержат в своём составе бензольное кольцо.
2. В зависимости от функциональной группы все органические соединения подразделяют на классы, важнейшими из которых являются (табл. 6):