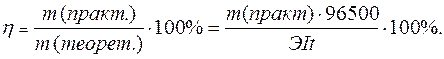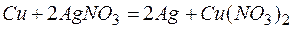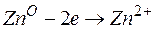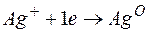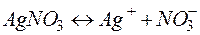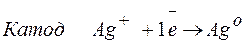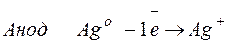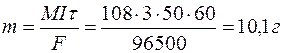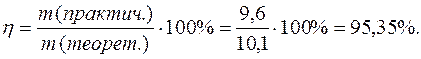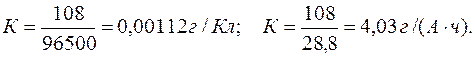При электролизе водного раствора АgNO3 с нерастворимым анодом в течение t=50 мин. при силе тока в I = 3,0 А на катоде выделилось mf = 9,6 г серебра. Вычислить выход по току.
Решение: Заряд пропущенный через электролит равен:
Теоретический массоперенос для произвольного иона равен:

- ионы серебра в растворе нитрата серебра имеют заряд n = +1;
- молярная масса серебра μ = 107,868 г/моль;
- Число Авогадро — Na;
- Число Фарадея — F=96500[Кл].
Подставляя полученные формулы в выражение для выхода по току получим:
Приведя заданные значений к одной системе размерностей проведем вычисление:
- Викифицировать статью.
- Добавить иллюстрации.
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Проставить интервики в рамках проекта Интервики.
- Переработать оформление в соответствии с правилами написания статей.
Wikimedia Foundation . 2010 .
Смотреть что такое "Выход по току" в других словарях:
выход по току — Доля тока (кол ва электричества), затрачив. в электролитич. процессе на получение продукта. Определяют отношением массы фактич. прореагировавшего вещ ва к теоретич., рассчитанной по закону Фарадея, в процентах или долях ед. Различают катодный и… … Справочник технического переводчика
выход по току — [current efficiency] доля тока (количества электричества), затрачиваемого в электролитическом процессе на получение продукта. Определяют отношением массы фактического прореагировавшего вещества к теоретическому, рассчитанной по закону Фарадея, в… … Энциклопедический словарь по металлургии
выход по току — srovinė išeiga statusas T sritis Standartizacija ir metrologija apibrėžtis Elektros srovės dalis, tenkanti tam tikram elektrodiniam vyksmui. atitikmenys: angl. current efficiency vok. Stromausbeute, f rus. выход по току, m pranc. rendement en… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
выход по току — srovinė išeiga statusas T sritis chemija apibrėžtis Elektros srovės dalis, tenkanti konkrečiam elektrodiniam procesui. atitikmenys: angl. current efficiency rus. выход по току … Chemijos terminų aiškinamasis žodynas
Выход по току на растворение платиновых металлов различной плотности тока — Материал анода Выход по току (в %·104) при плотности тока, кА/м2 0,5 1 1,5 2 3 … Химический справочник
ВЫХОД — [yield; exit]: выход годного [prime yield] 1. Отношение массы готовых изделий к массе заготовок для них. 2. Доля жидкого металла при плавке в массе металлической завалки; выход по току [current efficiency] доля тока (кол ва электричества),… … Металлургический словарь
выход шлака — [slag yield] технологический показатель, косвенно характеризующий богатство доменной шихты железом. Высокий выход шлака связан с ростом газодин. сопротивления столба шихты в доменной печи и с ростом потерь тепла с отрабатываемым шлаком. Суммарно… … Энциклопедический словарь по металлургии
выход по энергии — [power output] величина, обратная удельному расходу энергии на получение единицы готовой продукции методом электролиза; показывает, какая доля постоянного тока от общего подводимого к ванне количества электроэнергии используется на… … Энциклопедический словарь по металлургии
выход годного — [prime yield] 1. Отношение массы готовых изделий к массе заготовок для них. 2. Доля жидкого металла при плавке в массе металлической завалки; Смотри также: Выход выход шлака выход по энергии выход по току выход продукта … Энциклопедический словарь по металлургии
выход продукта — [product yield] отношение массы полученного продукта при обогащении к массе исходного материала. Смотри также: Выход выход шлака выход по энергии выход по току выход годного … Энциклопедический словарь по металлургии
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде:
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для расчетов используют математическое выражение обобщенного закона Фарадея:
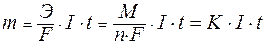
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) превышает его количество, рассчитанное согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току:
Примеры решения типовых задач.
Пример 1.Ряд активности металлов, электродных потенциалов.
Задача 1. Медная пластинка массой 10 г была погружена в раствор нитрата серебра, затем промыта водой и высушена. Масса ее оказалась равной 11,0 г. Сколько серебра из раствора выделилось на пластинке?
Решение. Для решения этой задачи необходимо знать стандартные электродные потенциалы металлов, т.е. место их в ряду напряжений (ряду активности металлов Бекетова).
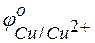
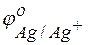
Из этих положительных потенциалов стандартный электродный потенциал меди менее положителен, следовательно, пойдёт реакция вытеснения:
Для того чтобы вычислить количество серебра, выделившегося на медной пластинке, надо помнить, что медная пластинка в этой реакции и сама растворяется, теряя в массе.
Обозначим количество растворившейся меди через x г, тогда масса медной пластинки с учётом её растворения будет (10-х) г, масса выделившегося серебра на основе реакции:
64,0 г Cu – 2 ∙ 108 г Ag
х г Cu – (1+х) г Ag
216х =64+64х, 152x=64, x=0,42 г.
Таким образом, в течение реакции растворилось 0,42 г меди и выделилось 1,0 + 0,42 = 1,42 г серебра.
Пример 2.Работа гальванического элемента и расчёт ЭДС.
Задача 1. Напишите уравнения реакций, происходящих при работе гальванического элемента, состоящего из цинковой и серебряной пластин, опущенных в растворы своих солей с концентрацией катионов, равной 1 моль/л.
Решение. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
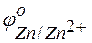
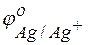
Металл, имеющий более отрицательное значение электродного потенциала при работе гальваничеcкого элемента, является анодом. В данном случае протекают реакции:
т.е. цинк, являясь анодом, растворяется при работе гальваничеcкого элемента, а серебро осаждается в виде металла на катоде. ЭДС гальванического элемента равна
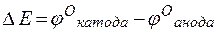
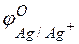
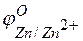
Пример 3. Зависимость электродных процессов от концентрации.
Задача 1. Рассчитайте, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода равна 0,1 моль/л, а у катода – 0,001 моль/л.
Решение. Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
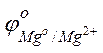
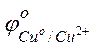
Следовательно, анодом будет магниевый электрод, катодом – медный. Электродный потенциал металла, опущенного в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
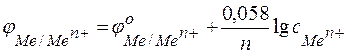
где: с – концентрация катиона, моль/л;
п – число электронов, принимающих участие в реакции.
Отсюда потенциал магниевого электрода
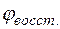
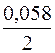
Потенциал медного электрода
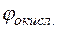
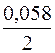
Тогда для гальванического элемента
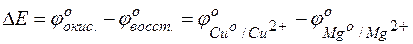
Пример 4. Определение возможности протекания реакции в гальвани-ческом элементе.
Задача 1. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса ΔG о 298, укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0 .
Решение. Надо составить схему гальванического элемента, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальваничекого элемента:
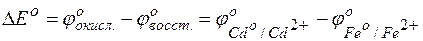
Изменение величины энергии Гиббса с величиной ЭДС связано соотношением:
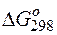
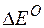
где: 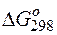
n – число электронов, принимающих участие в реакции;
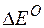
Находим 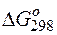
Так как 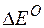
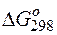
| 96500 Кл – 32 г |
| 1800 Кл – х г |
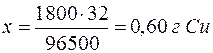 |
Пример 6. Определение электрохимического эквивалента и выхода по току.
Задача 1. При электролизе водного раствора AgNO3 в течение 50 минут при силе тока 3А выделилось 9,6 г серебра. Электролиз проводился с растворимым анодом. Напишите уравнение реакций катодного и анодного процессов и определите электрохимический эквивалент серебра в г/Кл и г/А . ч и выход по току.
Решение. Нитрат серебра диссоциирует:
Процессы, протекающие на электродах:
Молярная масса эквивалента Ag О =108 г/моль.
Определяем массу серебра, которая выделилась бы теоретически при прохождении через раствор данного количества электричества:
Последнее изменение этой страницы: 2016-12-15; Нарушение авторского права страницы
В большинстве реальных процессов наряду с основной электродной реакцией выделения металла происходят и другие, так называемые побочные процессы. В этом случае важно найти величины плотностей тока двух или более параллельных процессов, происходящих при одном и том же заданном потенциале.
Побочные процессы могут иметь различную природу. Как уже отмечалось, может иметь место выделение водорода в результате электролиза воды:
Кроме того, может происходить осаждение (соосаждение) другого металла:
Далее, возможно неполное восстановление некоторых ионов металлов, например:
Иногда наблюдается восстановление находящихся на поверхности оксидов:
Возможны также другие реакции, некоторые из которых могут быть чисто химическими.
Если второй (побочный) процесс заключается в выделении металла, то определение плотностей тока обоих процессов тесно связано с составом осаждаемого сплава. Действительно, отношение молярных концентраций металлов в сплаве пропорционально отношению соответствующих плотностей тока. Если же происходят побочные процессы другого типа, то вводится понятие выхода по току (ВТ) как отношения парциальной плотности тока целевого процесса к суммарной плотности тока:
Выход по току часто выражают в процентах.
Для практического нахождения ВТ катод взвешивают на аналитических весах до и после электролиза и параллельно этому точно измеряют количество прошедшего электричества электронным интегратором тока либо с помощью амперметра и секундомера.
Вычисляется ВТ как отношение реального прироста массы электрода к теоретической величине, найденной по закону Фарадея:
Если же величина ВТ для данного конкретного процесса уже известна, то ее можно подставить в формулу Фарадея для вычисления истинной толщины покрытия:
Величины ВТ для различных процессов сильно различаются и зависят как от выделяемого металла, так и от типа электролита, температуры, плотности тока, pH и т. д. Промышленные процессы, как правило, работают с высоким выходом по току; оценочные и усредненные значения ВТ для нескольких процессов приведены в табл. 1.4.
Выход металлов по току (усредненные величины) в некоторых распространенных электролитах